A la vuelta de las vacaciones de Semana Santa y Fiestas de primavera, en Anatomía retomamos nuestras funciones con mucha energía. Prueba de ello son todas las actividades que estamos realizando. Y como no, retomamos nuestra sesión de exposiciones sobre los descubrimientos más interesantes o importantes que nuestros alumnos han escogido.
Esta vez le ha tocado el turno a Alicia quien ha demostrado su interés por una nueva técnica que permite el desarrollo embrionario de bebés prematuros mediante la generación de un útero extracorpóreo. Esta técnica será de gran utilidad para disminuir el elevado índice de mortalidad en esta condición. Alicia nos ha demostrado su gran preparación y conocimiento del tema durante su exposición.
Aquí nos dejamos su trabajo, esperamos que lo disfrutéis tanto como nosotros.
Úteros extracorpóreo para apoyo vital de bebés de extrema prematuridad
El nacimiento prematuro es la principal causa de mortalidad entre los recién nacidos:
- prematuros extremos (menos de 28 semanas)
- muy prematuros (28 a 32 semanas)
Los bebés prematuros tienen más probabilidades que otros bebés de padecer enfermedades y complicaciones relacionadas con la inmadurez de sus órganos y su sistema inmunitario
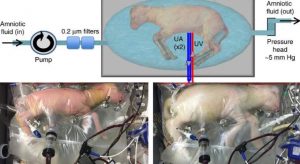
Los investigadores del Hospital Infantil de Filadelfia han creado un sistema extracorporal que han probado en crías de cordero. Un aparato que tiene un circuito de oxígeno sin bomba que se encuentra conectado al feto del cordero vía umbilical y a su vez se encuentra cerrado en una bolsa sellada (BioBag) en líquido amniótico que simula la placenta.
Los corderos con similares condiciones de extrema prematuridad que el ser humano alcanza las 4 semanas con la ayuda del aparato. Los corderos muestran una hemodinámica estable. A su vez muestran un crecimiento somático normal , maduración de pulmones y crecimiento cerebral y mielinización normales.
Para cubrir la función de la placenta, se usan varios tubos conectados al cordón umbilical, en vez de introducir tubos directamente en el cuerpo y forzar la entrada de nutrientes, el equipo optó por un medio más natural.
son los propios latidos del corazón del animal los que mueven el oxígeno proveniente del dispositivo. Al aprovechar el cordón umbilical, se evita que el animal use los pulmones antes de tiempo.
Procedimiento
El experimento empezó con crías de cordero que fueron extraídas del útero materno con una edad de entre 15 y 17 semanas. Las ovejas eran anestesiadas con 15mg de ketamina intramoscular y para mantener la anestesia , inhalaban isoflurane y propofol.
Se realizó una laparotomía en la línea media inferior para exponer el útero, con una pequeña histerotomía realizada para exponer la cabeza y el cuello de los corderos o cordón umbilical para poder realizarles una canulacion.
Los corderos sometidos a la canulación de los vasos umbilicales se colocaron para exponer el cordón umbilical, con tejido conectivo diseccionado para exponer las arterias y venas umbilicales.
Las cánulas umbilicales se colocaron en una vena umbilical, así como en dos arterias umbilicales, con suturas estabilizadoras colocadas en los sitios de inserción.
Circuito
El circuito sin bomba consistía en un oxigenador de fibra hueca de baja resistencia (Quadrox-ID Pediatric Oxygenator, Maquet) conectado a una cánula umbilical hecha a medida.
En estudios posteriores que utilizaron corderos más pequeños, se utilizó un oxigenador más pequeño (Quadrox-ID Neonatal Oxygenator, Maquet).
Las conexiones se establecieron como un circuito de oxigenación extracorpóreo arterial-venosa, con las arterias umbilicales que suministran al puerto de entrada del oxigenador y la vena umbilical que proporciona un flujo de salida del oxígeno y está conectado al puerto de salida del oxigena3dor.
El gas suministrado al oxigenador fue una mezcla de aire medicinal, nitrógeno y oxígeno medidos para alcanzar valores de gas en sangre fetal.
Mantenimiento del cordero en circuito
- Tras la estabilización y la transferencia de los corderos al incubador de líquidos, se administró por vía intravenosa una infusión continua de heparina y prostaglandina E1.
- Las prostaglandinas están indicadas como tratamiento paliativo en neonatos con cardiopatías ductus-dependientes. La administración de PGE1 abre el ductus arterioso y, dependiendo de la lesión, aumenta el flujo pulmonar y el flujo sistémico o favorece la mezcla entre las dos circulaciones.
- La sangre arterial y venosa se analizaron cada 1-8 h para controlar los valores de gas en sangre, electrolitos y coagulación.
- Se administraron analgésicos y ansiolíticos durante períodos de agitación fetal percibida (movimientos fetales repetitivos e inquietos, deglución excesiva, taquicardia e hipertensión)
Conclusión
Un circuito sin bomba alimentado por el corazón del feto no es un concepto nuevo y ha sido el enfoque inicial adoptado por muchos investigadores.
De acuerdo con los investigadores, el objetivo final de este diseño es lograr que los humanos nacidos prematuros a partir de la vigesimotercera semana puedan “alcanzar el desarrollo y el crecimiento normal de un bebé de 28 semanas, sacándolos del umbral que pone en riesgo su supervivencia”.
https://www.nature.com/articles/ncomms15112#additional-information
Prof. Susana Nieto